首頁 ﹥ 動態消息 > 2017年媒體報導 > 我國中藥材及飲片的質量情況及有關問題分析 2017-01-26
我國中藥材及飲片的質量情況及有關問題分析
【資料來源:2017-01-10 大品種聯盟】
⊙作者:魏鋒,劉薇,嚴華,石岩,張文娟,張萍,程顯隆,馬雙成
⊙編輯:星河
中藥材及飲片是中醫藥的重要組成部分。中藥材及飲片的質量是中藥質量的根本,也是保證中醫臨床用藥安全有效的關鍵。近年來,隨著產業化和市場化的不斷擴大和升級,我國中藥材生產逐步形成了以中藥材種植養殖、產地初加工和專業市場為主要環節的中藥材產業,也形成了一批通過GMP認證並初具規模的中藥飲片企業。但受資源緊缺、市場需求不斷擴大、產業鏈過長、生產技術和規範不夠完善、從業人員質量意識薄弱、監管不到位等多種因素影響,中藥材及飲片質量存在一些問題,主要表現在:種植養殖環節標準化、規範化落實不到位,濫用農藥化肥等造成有害物質殘留;採收、產地初加工環節操作不規範導致劣質藥材增多;中藥飲片生產及流通環節違法染色增重、摻雜使假現象時有發生;中藥材專業市場以次充好,以假充真,制假售假,違法經營中藥飲片和其他藥品的現象屢禁不止,社會反映強烈。這些問題嚴重影響中藥材質量安全,危害公眾健康,阻礙中藥材產業和中醫藥事業健康發展。
2013年,國家食品藥品監督管理總局組織開展了藥品“兩打兩建”專項行動,各省市藥品監管部門針對近年來中藥材及飲片領域存在的以上問題進行了檢查和抽驗工作。現將2013年各省檢驗和質量情況進行匯總和分析。雖然各地抽樣目的、抽樣環節、品種數量、覆蓋範圍、檢驗項目等各有側重,但總體質量數據和信息仍然可以反映當前我國中藥材及飲片的質量狀況,可為相關部門監管政策制定、標準修訂和完善提供依據。
1.質量基本情況
2013年,全國30個省、市、自治區(除西藏自治區、港澳台地區)共抽驗中藥材及飲片45297批,合格28960批,合格率為:63.93%。 30個省、市、自治區的質量情況有較大差異,其中北京、天津、雲南、河南、海南五省區的合格率均達90%以上,重慶、寧夏、廣西三省區合格率較低,均在30%以下。 13個省區低於全國平均合格率,分別是:廣東、廣西、湖北、湖南、吉林、江蘇、遼寧、寧夏、青海、山西、上海、四川、重慶(圖1)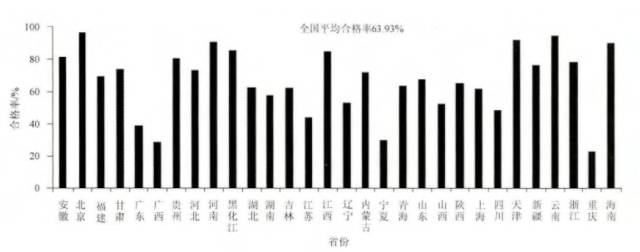
圖1:2013年全國中藥材及飲片抽驗合格率情況
由於中藥材與飲片的特殊性,多數省市主要針對質量問題比較突出的中藥材與飲片品種進行監督抽驗為主要形式,抽樣目的性和針對性明確,因此不合格率相對較高。此不合格率雖然不能客觀反映中藥材及飲片市場的真實質量情況,但經過對質量問題的具體分析,可發現並呈現出種類集中,主要問題相似的現象。
2.主要質量問題
在各省市藥品監管部門的檢查和抽驗過程中主要發現以下8方面質量問題。
2.1 以偽品冒充正品
以偽品冒充正品主要集中在正品品種來源較少、資源稀少的品種。問題較突出的品種有:以其他雜木浸泡松香冒充沉香;薯蕷科其他品種冒充山藥;木防己、漢防己冒充防己;非藥典品種的青蛙輸卵管冒充蛤蟆油;滇棗仁冒充酸棗仁;赤鏈蛇幼蛇冒充金錢白花蛇;水半夏冒充半夏;大黃中摻雜偽品大黃;沙蓯蓉充當肉蓯蓉,益智仁充砂仁等。
2.2 不同藥材品種混用
不同來源藥材相互替代或混用。問題較突出的品種有:五加皮與香加皮、地骨皮混用;麥冬與山麥冬混用;北豆根冒充山豆根;伊貝母充當川貝母,木瓜與光皮木瓜混用;通草與小通草混用;桑寄生與槲寄生混用等。
藥典分列品種混用。主要品種有:葛根與粉葛混用;金銀花與山銀花混用;五味子與南五味子混用;黃柏與關黃柏混用等。
2.3 非藥用部位、雜質過多
問題較突出的品種有:夏枯草果穗摻莖葉;巴戟天木質部所佔比例較大;細辛未除盡地上部分;山茱萸果核部分過多;牡丹皮、遠志未去木芯;柴胡摻地上莖;黃連夾雜有大量的泥土;皂角刺、鉤藤摻藤莖等。
2.4 非法染色
非法添加染料的品種主要有:蒲黃、延胡索、黃柏、石斛、黃芩、黃連、五味子、紅花等。續斷飲片染成紅色摻入丹參中出售。
2.5 摻泥沙或其他物質增重
問題較突出的品種有:穿山甲、豬苓、海金沙、菟絲子、全蠍、海馬、水蛭、土鱉蟲、海金沙、殭蠶、紫河車、雞內金、砂仁等。
2.6 提取過的飲片藥渣再流通藥用
抽驗發現的品種有天麻、厚朴、蒼朮等。
2.7 不按炮製規範炮製
如法半夏炮製未加甘草;附子、制川烏和製草烏炮製過度,導致其中的有效成分含量太低,不符合標準要求;硫黃熏蒸現象普遍,二氧化硫殘留量超標,如白芷、粉葛、菊花等。
2.8 貯藏不當
如熟地黃吸濕,致水分不合格等。
按照以上主要質量問題,對本次抽驗結果進行統計,不合格率較高的150種常用中藥材及飲片品種情況見表1。
表1:2013年全國抽驗不合格率較高的150種中藥材及飲片
3標準和方法問題
標準是檢驗和結果判定的依據,在日常抽驗過程中,常出現的標準與方法問題,歸納如下。
3.1 補充檢驗方法問題
國家局頒布的補充檢驗方法是監督檢驗的重要依據,但由於補充檢驗方法需要研究和審核批准,永遠滯後於市場監管,難以滿足並及時適應中藥飲片打假治劣的需要。如近期發現的紅花、黃連的摻偽染色所使用的染料和色素已經超出了已批准的補充檢驗方法所涵蓋的染色情況。
3.2 飲片標準不統一
目前飲片除了《中國藥典》標準外還有各地的砲制規範,而《中國藥典》規定的飲片規格不足,各地中藥飲片標準又不統一,給檢驗和監管帶來很大的困難。例如肉蓯蓉炮製品有淡蓯蓉、酒蓯蓉、咸蓯蓉,藥典收載了淡蓯蓉和酒蓯蓉,而咸蓯蓉並未收載在法定標準中,對其性狀如何進行判斷,有待制定全國統一的飲片炮製規範。
3.3 藥材標準有待提高完善
《中國藥典》有些藥材或飲片性狀描述過於簡單,也無其他鑑別檢查項目,正品與偽品無法區分,如冬蟲夏草、紫河車、鹿茸、蛤蟆油等名貴藥材。
3.4 檢驗項目設置合理性問題
有些藥材或飲片顯微鑑別設置不合理,導致無法檢驗。如顯微鑑別的橫切面,如大黃、大血藤、防己及大部分果實種子類等因藥材難以完整或樣品太小而無法製片觀察。
3.5 多品種來源樣品的檢驗問題
對於藥材標準中多品種來源的品種如黃連、川貝母、威靈仙、柴胡、菊花等,若多來源的品種混在一起,都是藥典收載的品種,檢驗中性狀只能混出,無法確定具體的種,比如菊花、黃連藥材:收載了味連、雅連、雲連,性狀、橫切面單獨規定,含量僅收了味連的,雅連、雲連的含量如何檢驗?柴胡:收載了北柴胡、南柴胡,性狀單獨規定,薄層鑑別和含量僅收了北柴胡的,那麼南柴胡如何檢驗?南柴胡和北柴胡混合的樣品如何檢驗?
3.6 栽培品性狀變異問題
目前藥典中性狀鑑別特徵主要是針對野生品製定的,但是市場上大量流通的則是栽培品,且中藥栽培品的應用也是趨勢,如甘草、黨參、桔梗、防風、柴胡、半夏等。因此建議藥典對部分品種的性狀項適當修訂,增加對栽培品的規定和描述。另外,對栽培品的種植年限尚無規定,在檢驗中發現栽培防風因年限太短,在粉末顯微鑑定中很難檢識到油管。故建議在標準制定時應結合中藥材種植的規範性。
4監管策略和有關建議
中藥材不規範種植(濫用農藥、化肥、生長激素)、不規範加工炮製(硫黃過度熏蒸,未按飲片企業GMP生產)、不規範的流通和使用(有不少藥房、診所不從飲片廠進貨而直接從藥材市場進貨,部分中成藥企業甚至專門尋找劣質低廉的藥材投料用),這些現像不僅嚴重影響了中藥材飲片的質量,在某種程度上促生了製假售假行為的蔓延。國家藥品監管部門曾多次對17家中藥材專業市場進行抽驗,有一定效果。但中藥飲片納入醫保,成為基本藥物,監管力度仍有待加強。鑑於中藥材是具有農副產品和藥品雙重屬性的特殊商品,其產業鏈條長、生產和經營長期存在散、小、亂的問題,為進一步加強監管、保障質量和安全,建議採取以下措施。
4.1 統一和提高標準,完善法規
目前藥材市場由屬地藥品監督管理局監管,但是藥材市場有藥品經營許可證和沒有藥品經營許可證兩種經營者混雜,還有地方保護依然存在;加之目前藥市流通的藥材品種有300多種是現行《中國藥典》未收載的品種,雖然大部分品種有地方藥材標準,但是由於同物異名和同名異物的存在、各標準檢測項目不同,致使藥材檢驗和市場監管難度加大。鑑於藥材市場管理的多面性和復雜性,建議完善相關法規,明確中藥材和農副產品的屬性與界限,藥材和飲片的界定,藥材市場的功能、定位以及監管主體。
4.2 完善追溯體系,加強監管力度
按照《藥品管理法》第七十四、七十五條規定,生產、銷售假藥的,沒收違法生產、銷售的藥品和違法所得,並處違法生產、銷售藥品貨值金額二倍以上五倍以下的罰款;生產、銷售劣藥的,沒收違法生產、銷售的藥品和違法所得,並處違法生產、銷售藥品貨值金額一倍以上三倍以下的罰款。實際執法過程中,按該批次貨值金額處罰,對被罰者而言,多則幾千元,少則僅幾百元的罰款,無足輕重,而對監管部門而言,要判斷一批假藥或劣藥的執法代價遠高於此。這就造成一邊在違法被處罰,另一邊卻還在繼續造假的局面,使監管執法難以產生明顯成效。因此,應建立完整的追溯體系,按照中藥材專業市場的經營範圍和要求以及中藥飲片生產經營有關規定,落實責任主體,加強轄區行政監管,對違法經營、制假售假、危害公眾用藥安全的違法違規行為,要依法嚴肅處理。教育和監督商戶守法經營、誠信經營,共同維護市場正常、規範的經營秩序。
4.3 找准環節,加強對終端的監管
中藥材是中藥生產的源頭,GMP要求飲片、成藥企業必須以合格的藥材和飲片為原料進行生產。建議結合中藥飲片和中成藥生產管理規範、藥品流通和使用等相關的法規要求,強化對使用者或使用終端(中成藥企業、中藥飲片廠、醫院藥房、藥店)的監督抽驗、質量監管。特別應加強對基層藥店、診所、醫療機構銷售和使用的中藥飲片購進來源及質量的監督檢查,對從非法渠道購進中藥飲片的行為依法嚴懲。
4.4 加強各省市間合作與交流,建立統一的信息平台
構建全國的中藥材及飲片質量信息平台,加強各省監督檢驗人員的交流、配合,使全國中藥材質量監管形成網絡,讓製售假劣行為無處可藏。建議國家局建立快速發布中藥飲片補充檢驗方法及標準的電子信息平台,讓基層監督檢驗機構能及時獲取。
4.5 促進種植養殖規範化,注重源頭治理
質量源於生產,源於過程管理,中藥材是中藥飲片和中成藥的原料,應通過宣傳、檢查、督導等方式,培養種植養殖從業者、飲片生產經營者的專業技術素養、質量意識和責任意識,提高種植養殖的規範性,從源頭上確保中藥材的質量。
【本文來源:《中國藥學雜誌》2015年2月第50卷第4期,作者授權中藥大品種聯盟(BBTCM


